LCHの病態(Ver.1. 202403)
1. はじめに
ランゲルハンス細胞組織球症 (Langerhans cell histiocytosis: LCH) は、1900年頃より好酸球性肉芽腫 (Eosinophilic granuloma: EG) 、Hand-Schüller-Christian (HSC) 病、Letterer-Siwe (LS) 病 と全く病像の異なる3つの別の疾患として捉えられていた。現在の分類では、EGは骨の単一臓器型LCH、HSC病はリスク臓器浸潤 (肝病変・脾病変・造血器病変) を伴わない多臓器型LCH、LS病はリスク臓器浸潤陽性の多臓器型LCHに該当すると考えられる。1950年代になり、病理学的にこれらはいずれも組織球の増殖症であることが判明しHistiocytosis Xとしてまとめられたが、依然その正体は不明で病名に“X”がついた。その後、その組織球は、皮膚の常在性マクロファージであるLangerhans細胞と同様に細胞質にBirbeck顆粒をもつことが電子顕微鏡により明らかになった。このことから、1980年代にLCHと改称された1)。LCHは、“反応性組織球増殖”なのか、“腫瘍性組織球増殖”なのか、長年議論されてきたが、2010年に半数の症例でLCH細胞にBRAF V600E変異を認めると報告2)されたことを契機に、一気に病態解明が進み、現在LCHは“炎症性骨髄性腫瘍”3)という概念で捉えられている。LCHの病態解明の進展について解説する。
2. LCH細胞はmitogen-activated protein kinase (MAPK) 経路の遺伝子に活性化変異をもつ
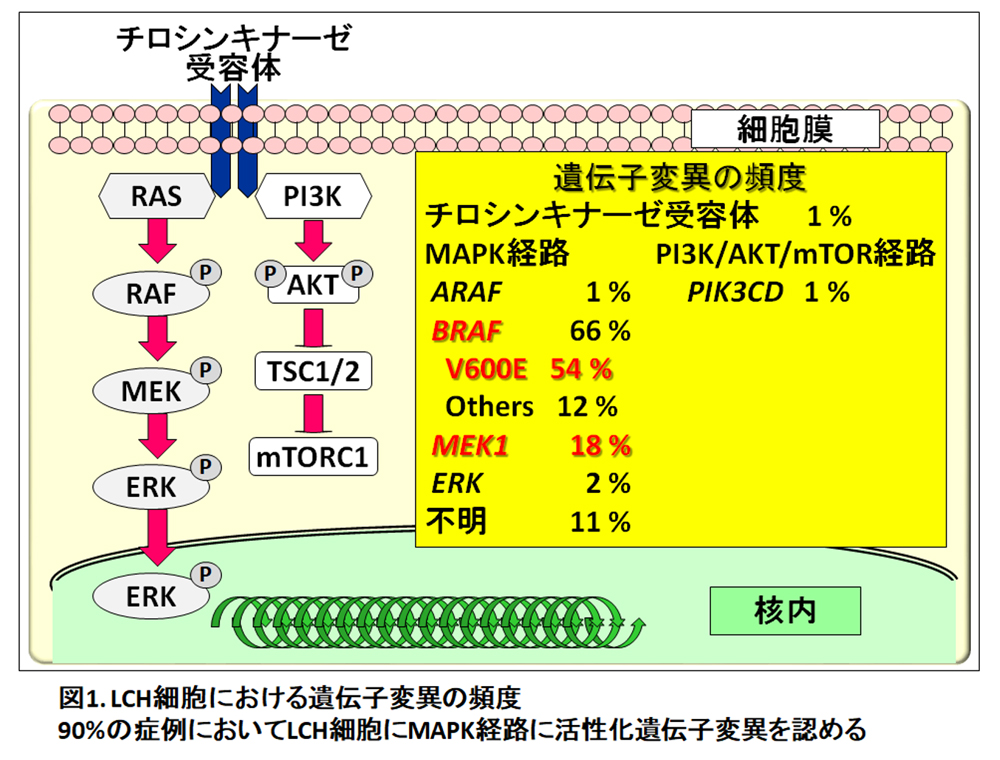
2010年、小児LCH患者の70%、成人LCH患者の40%において、LCH細胞にBRAF V600E変異が認められると報告された2)。その報告の中で、BRAF変異の有無にかかわらず、ほとんどすべての例で、ERKのリン酸化が認められることも明らかにされた。その後、MAPKシグナル経路の遺伝子に、相互排他的な活性化変異が次々に見出された4)。その中で、BRAF V600E変異が最も多く約55%に、次いでMEK1変異が約20%、V600E以外のBRAF変異 (in-frame欠失やsplicing異常、融合遺伝子) が約10%に認められる5) (図1)。
これらのことより、LCH細胞は、がん遺伝子に活性化変異を持つ腫瘍性細胞であることが明らかになった。
3. LCH細胞は骨髄由来である
LCHは、集簇する組織球(LCH細胞)はBirbeck顆粒陽性で、表皮の常在マクロファージであるLangerhans細胞 (LC) に組織学的に類似することから命名された。組織特異的な常在マクロファージには、そのほかに肝のKupper細胞、脳のmicrogliaなどがあるが、それらは胎児期の卵黄嚢造血を起源とする。LCH細胞の遺伝子発現プロファイルを、卵黄嚢造血由来の表皮LCと骨髄由来の未熟樹状細胞と比較したところ、後者に類似していた6)。また、BRAF V600E変異陽性のLCH症例においては、骨髄のCD34陽性細胞にも同変異が検出される7)。
これらのことから、LCH細胞は骨髄造血を起源とすることが明らかになった。
4. LCHの病型は造血細胞分化のどこで遺伝子変異が生じるかによって決まる
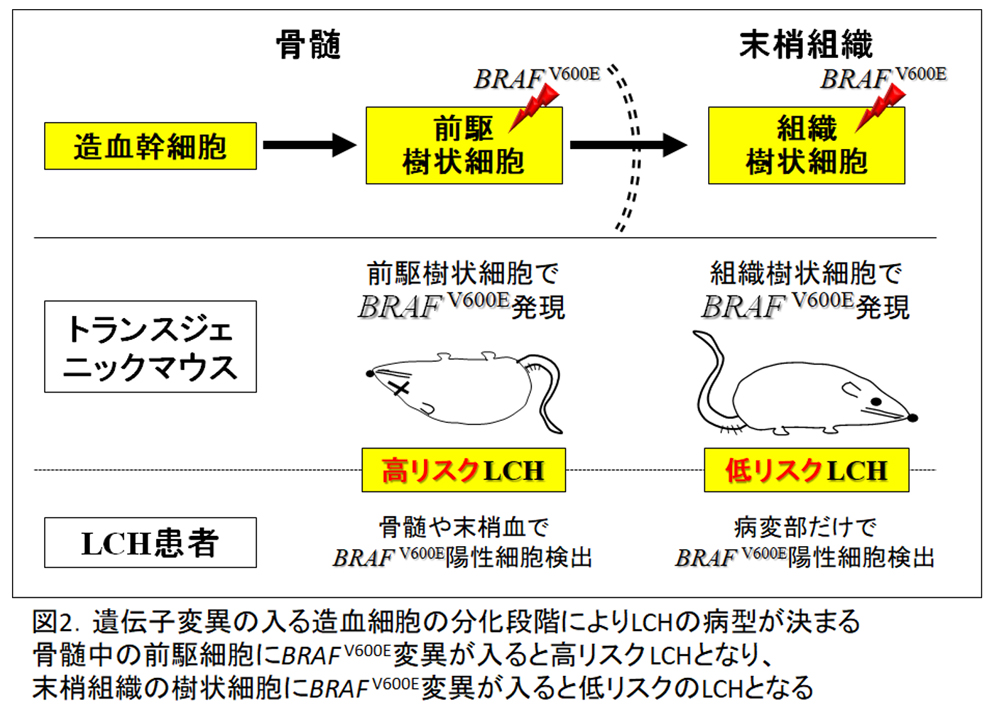
樹状細胞前駆細胞に発現するCD11cのプロモーター下でBRAF V600Eを強制発現させたトランスジェニックマウスには高リスクLCH様の病変が再現されるのに対し、組織の樹状細胞に発現するCD207のプロモーター下でBRAF V600E変異を発現させたトランスジェニックマウスには低リスクLCH様の病変が再現される8)。また、BRAF V600E変異陽性のLCH症例において、高リスク患者では骨髄のCD34陽性細胞および末梢血のCD11c陽性細胞やCD14陽性細胞でも同変異が検出されるが、低リスク患者では病変部以外では同変異は検出されない8) (図2)。
このことから、BRAF V600E変異はLCHのドライバー変異であり、LCHのリスク病型は樹状細胞分化のどの段階において変異が生じたかに依存することが示唆された。
5. 発がん遺伝子誘発細胞老化によって造血細胞分化は単球系へ偏位する
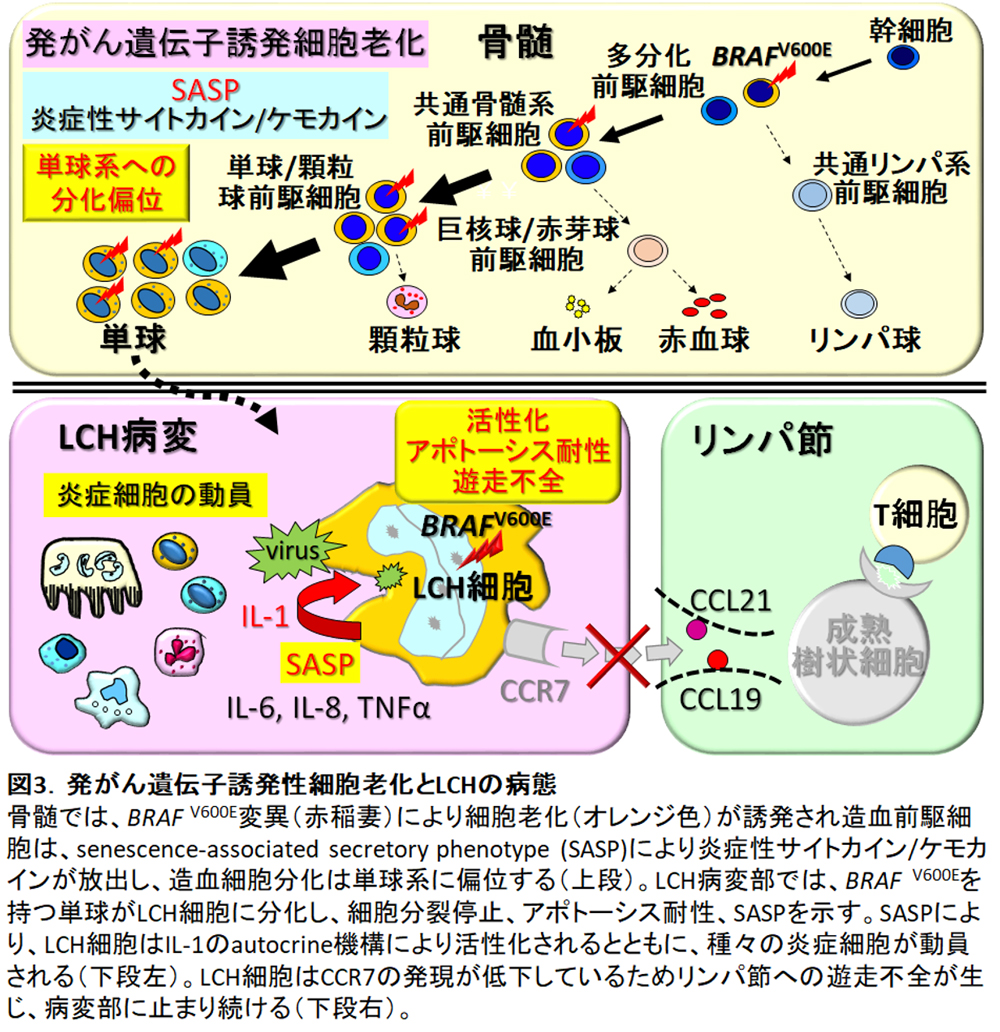
一般に、悪性腫瘍は、多くの遺伝子変異の積み重なりによって発症する。LCHと同様にBRAF V600E変異を持つ黒色腫では、1細胞当たり200を超える遺伝子変異が認められる。一般に血液腫瘍は固形腫瘍に比べ遺伝子変異が少ないが、LCHでは1細胞当たりの遺伝子変異の数は中央値1個 (幅0-5) と特に極めて少なく、ほとんどの例は、遺伝子変異はMAPK経路に1つだけである4)。BRAF V600E変異のみの場合には、発がん遺伝子誘発細胞老化(oncogene-induced senescence)が生じ、p16(INK4a)の発現により細胞周期は停止する9)。LCH細胞は、発がん遺伝子誘発細胞老化の状態にあり、細胞周期は停止しており、増殖はせず、アポトーシス耐性となっている10)。
発がん遺伝子誘発細胞老化が生じると細胞老化随伴分泌現象 (senescence-associated secretory phenotype: SASP) が誘導される。SASPにより多量に分泌されるIL-1, IL-6, IL-8, TNF-αなどの炎症性サイトカインによって、造血前駆細胞の分化を単球系に偏位する10)(図3上段)。
6. LCH細胞はアポトーシス耐性で、SASPにより活性化し、リンパ節へ遊走せず、病変部に集簇する
単球から分化した未熟樹状細胞の形質を示すLCH細胞も細胞老化しており、アポトーシス耐性11)でSASPも持続する。LCH細胞は、IL-1のautocrine / paracrineループにより活性化する12,13)。また、SASPにより炎症細胞が病変部に動員され、高度の炎症を伴うLCH病変が形成される10) (図3下段左)。
正常な未熟樹状細胞は病原体と遭遇すると活性化し、成熟し、CC Chemokine receptor (CCR)7を発現し、リンパ節に発現するCC Chemokine ligand (CCL)19およびCCL21に向かって遊走し、リンパ節内のTリンパ球に抗原提示する。BRAF V600E変異陽性LCH細胞は、CCR7の発現が低下しておりリンパ節への遊走不全が生じている11) (図3下段右)。
これらのことから、LCH細胞は、病変部位で増殖しているのではなく、アポトーシス耐性と遊走不全のために蓄積し集簇していると考えられる。
7. 炎症により組織破壊が生じる
LCH病変部位には、LCH細胞に加えて、好酸球やリンパ球、破骨細胞様巨細胞など、さまざまな炎症細胞が浸潤している。これらの細胞は互いに刺激して活性化し、重度の炎症を引き起こす14)。LCHの臓器障害は、LCH細胞の“増殖”によるのではなく、この重度の炎症による。この炎症を反映し、血清中の炎症性サイトカイン・ケモカイン値は、疾患の進展度に応じて上昇する15)。特に、高リスク患者ではIL-18やosteopontin (OPN) の上昇があり15.16)、サイトカインストームから多臓器不全を引き起こす。
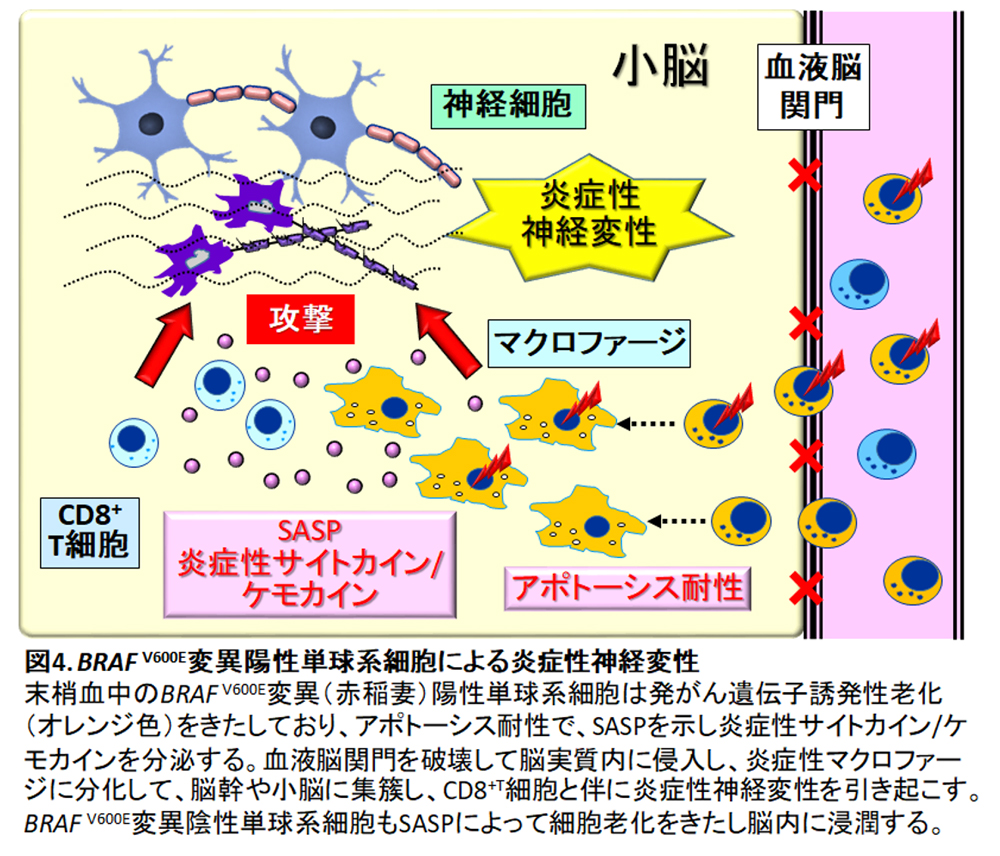
8. BRAF V600E変異陽性単球系細胞が脳内へ浸潤し、炎症性神経変性が生じる
LCH関連中枢神経変性症を発症(LCH-neurodegeneration [ND])した患者は90%以上がBRAF V600E変異陽性例であり、BRAF V600E変異陽性例は陰性例よりも10倍以上LCH-NDの発症率が高い(33.1% vs. 2.9%)17)。
LCH-ND患者では、BRAF V600E変異アレルが髄液中で検出される率は低い(10%)が末梢血単核球中では高率(LCH治療開始前:ND患者59% vs. 非ND患者15%、活動性病変消失時期:ND患者22% vs. 非ND患者0%)に検出され、髄液中で炎症性サイトカイン/ケモカインであるOPNが上昇しており、脳病変では血管周囲にBRAF V600E変異陽性のマクロファージが浸潤しておりOPNが高発現している18)。
造血幹細胞にBRAF V600E変異を発現させたトランスジェニックマウスは高リスクLCHを呈し、末梢血中に発がん性遺伝子誘発性細胞老化の特性をもったBRAF V600E変異陽性単球系細胞が検出され、この細胞が血液脳関門を破壊して脳実質内に侵入し、そこで炎症性マクロファージに分化し、脳幹や小脳に集簇し、炎症性神経変性を引き起こす。脳内に浸潤しているBRAF V600E変異陽性マクロファージはSASPを示しアポトーシス耐性である。このとき、脳内に浸潤している炎症性マクロファージのうち、BRAF V600E変異陽性の割合は10%弱で、BRAF V600E変異陰性が大半を占める19)。おそらくこれは、BRAF V600E変異陰性の単球系細胞がSASPによって老化細胞となり20)、脳内に浸潤しやすくなり脳病変を増悪させていると考えられる(図4)。
8. まとめ
LCHは骨髄由来で、MAPK経路に変異を持つ、アポトーシス耐性でSASPを示す老化組織球による炎症性腫瘍疾患である。
参考文献
- Arceci RJ. The histiocytoses: the fall of the Tower of Babel. Eur J Cancer. 1999; 35: 747-767.
- Badalian-Very G, Vergilio JA, Degar BA, et al. Recurrent BRAF mutations in Langerhans cell histiocytosis. Blood. 2010; 116: 1919-1923.
- Berres ML, Merad M, Allen CE. Progress in understanding the pathogenesis of Langerhans cell histiocytosis: back to Histiocytosis X? Br J Haematol. 2015; 169: 3-13.
- Chakraborty R, Hampton OA, Shen X, et al. Mutually exclusive recurrent somatic mutations in MAP2K1 and BRAF support a central role for ERK activation in LCH pathogenesis. Blood. 2014; 124: 3007-3015.
- Durham BH, Lopez Rodrigo E, Picarsic J, et al. Activating mutations in CSF1R and additional receptor tyrosine kinases in histiocytic neoplasms. Nat Med. 2019; 25: 1839-1842.
- Allen CE, Li L, Peters TL, et al. Cell-specific gene expression in Langerhans cell histiocytosis lesions reveals a distinct profile compared with epidermal Langerhans cells. J Immunol. 2010; 184: 4557-4567.
- Durham BH, Roos-Weil D, Baillou C, et al. Functional evidence for derivation of systemic histiocytic neoplasms from hematopoietic stem/progenitor cells. Blood. 2017; 130: 176-180.
- Berres ML, Lim KP, Peters T, et al. BRAF-V600E expression in precursor versus differentiated dendritic cells defines clinically distinct LCH risk groups. J Exp Med. 2014; 211: 669-683.
- Michaloglou C, Vredeveld LC, Soengas MS, et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 2005; 436: 720-724.
- Bigenwald C, Le Berichel J, Wilk CM, et al. BRAFV600E-induced senescence drives Langerhans cell histiocytosis pathophysiology. Nat Med. 2021; 27: 851-861.
- Hogstad B, Berres ML, Chakraborty R, et al. RAF/MEK/extracellular signal-related kinase pathway suppresses dendritic cell migration and traps dendritic cells in Langerhans cell histiocytosis lesions. J Exp Med. 2018; 215: 319-336.
- Murakami I, Wada N, Nakashima J, et al. Merkel cell polyomavirus and Langerhans cell neoplasm. Cell Commun Signal. 2018; 16:49.
- Murakami I, Matsushita M, Iwasaki T, et al. Interleukin-1 loop model for pathogenesis of Langerhans cell histiocytosis. Cell Commun Signal. 2015; 13: 13.
- Morimoto A, Oh Y, Shioda Y, et al. Recent advances in Langerhans cell histiocytosis. Pediatr Int. 2014; 56: 451-461.
- Morimoto A, Oh Y, Nakamura S, et al. Inflammatory serum cytokines and chemokines increase associated with the disease extent in pediatric Langerhans cell histiocytosis. Cytokine. 2017; 97: 73-79.
- Oh Y, Morimoto A, Shioda Y, et al. High serum osteopontin levels in pediatric patients with high risk Langerhans cell histiocytosis. Cytokine. 2014; 70: 194-197.
- Héritier S, Barkaoui MA, Miron J, et al. Incidence and risk factors for clinical neurodegenerative Langerhans cell histiocytosis: a longitudinal cohort study. Br J Haematol. 2018; 183: 608-617.
- McClain KL, Picarsic J, Chakraborty R, et al. CNS Langerhans cell histiocytosis: Common hematopoietic origin for LCH-associated neurodegeneration and mass lesions. Cancer. 2018; 124: 2607-2620.
- Wilk CM, Cathomas F, Török O, et al. Circulating senescent myeloid cells infiltrate the brain and cause neurodegeneration in histiocytic disorders. Immunity. 2023; 56: 2790–2802.
- Biavasco R, Lettera E, Giannetti K, et al. Oncogene-induced senescence in hematopoietic progenitors features myeloid restricted hematopoiesis, chronic inflammation and histiocytosis. Nat Commun. 2021; 12: 4559.